Водород нужен для чего
Водород нужен для чего
Сферы применения водорода
Современную промышленность сложно представить без применения технических газов на различных этапах производства. На сегодняшний день водород входит в тройку наиболее востребованных промышленностью газов, уступая лишь кислороду и азоту.
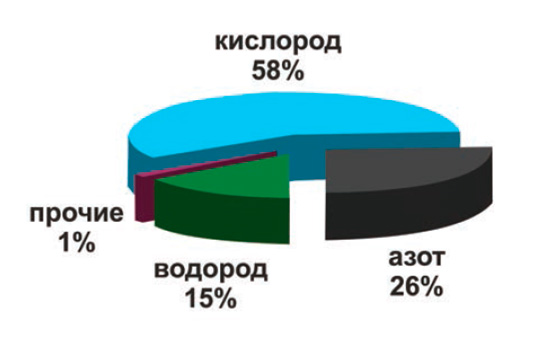 |
| Структура производства промышленных газов в России, % |
Водород относится к числу важнейших видов сырья химической и нефтехимической промышленности. Свойства этого газа обуславливают его применение и в других отраслях промышленности: металлургической, пищевой, стекольной, электронной, электротехнической.
Структура потребления водорода в России в 2013 г.
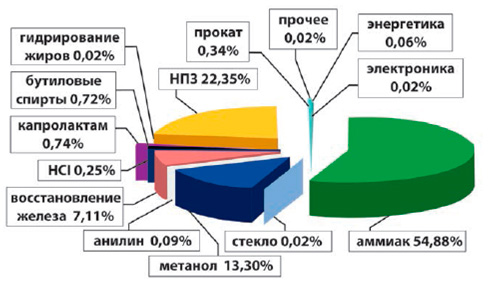
| Аммиак | 54,88% |
| Нефтеперерабатывающие заводы | 22,35% |
| Метанол | 13,30% |
| Восстановление железа | 7,11% |
| Капролактам | 0,74% |
| Бутиловые спирты | 0,72% |
| Прокат | 0,34% |
| HCl | 0,25% |
| Анилин | 0,09% |
| Энергетика | 0,06% |
| Гидрогенизация жиров | 0,02% |
| Электроника | 0,02% |
| Стекло и керамика | 0,02% |
| Прочее | 0,02% |
Химическая промышленность
В России основная область потребления водорода – производство химических продуктов, прежде всего аммиака и метанола.
Лидерами по потреблению водорода являются предприятия, производящие аммиак NH 3 . Сейчас на 28 предприятиях в России используется 2,46 млн.т. водорода в год.
Потребление водорода при синтезе метанола CH 3 OH составило 0,6 млн.т. в 2013 г.
Потребление водорода в остальных сегментах химической промышленности не превышает 90 тыс.т. – 3% от объема потребления.
Нефтеперерабатывающая промышленность
Повышается потребность НПЗ в водороде, необходимом для получения топлив из тяжелого высокосернистого сырья. Огромное количество водорода требуется для установок гидрообессеривания, гидрокрекинга дистиллятов, гидроочистки, изомеризации, производств смазочных материалов. Кроме того, водород на НПЗ используется для активации катализаторов риформинга и регенерации катализаторов изомеризации.
Металлургия
Основной областью применения водорода в металлургии является производство металлизированного сырья методом прямого восстановления железа. Сейчас в этом процессе потребляется около 320 тыс.т. водорода.
Значительные объемы водорода расходуются в технологических процессах прокатного производства (при термической обработке холоднокатаного проката). Потребление водорода – около 15 тыс.т. в год.
Водород на металлургических предприятиях используется также для создания защитной азотно-водородной атмосферы при термообработке труб.
Стекольная промышленность
В стекольной промышленности водород применяется при производстве листового стекла float-методом, а также для получения кварцевого стекла, которое изготавливают плавлением чистого горного хрусталя, кварца или синтетического оксида кремния в водородно-кислородном пламени.
Энергетика
В энергетике водород используется для охлаждения мощных турбогенераторов, благодаря его высокой теплопроводности и коэффициенту диффузии, а также нетоксичности. По оценкам, в энергетике на ТЭЦ, АЭС потребляется около 4-5 тыс.т. водорода в год.
Пищевая промышленность
В пищевой промышленности водород используется в процессах гидрогенизации масел и жиров при получении твердых жиров (маргарина). Объем потребления водорода масложировыми комбинатами оценивается на уровне 1,5 тыс.т. в год.
Среди прочих потребителей водорода – обогатительные комбинаты, заводы, занимающиеся фабрикацией ядерного топлива, предприятия электронной и электротехнической промышленности, транспортные и газовые компании, фармацевтика.
Чтобы уточнить стоимость или получить дополнительную консультацию,
вы можете позвонить по тел.: +7 (495) 545-44-62 или отправить запрос .
Водород: энергия «чистого» будущего

Водород, полученный с использованием низкоуглеродных технологий, может быть эффективным средством декарбонизации тех отраслей промышленности, которые в настоящее время потребляют большое количество угля или газа в качестве источника энергии, либо такой водород может стать вариантом замены уже используемого водорода на низкоуглеродный (например, в нефтепереработке и химической промышленности).
Несмотря на то, что сегодня водород используется в основном в промышленном производстве, этот химический элемент имеет значительный потенциал расширения областей применения.
В сфере электроэнергетики он может использоваться в качестве углеродно-нейтрального топлива как для централизованной, так и для распределенной генерации, выступать средством накопления энергии и применяться в качестве вторичного энергоносителя, аккумулирующего энергию, которая производится на объектах возобновляемой энергетики.
Кроме того, использование водорода в смеси с метаном или в чистом виде в системе газоснабжения рассматривается в качестве направления декарбонизации децентрализованного теплоснабжения и ЖКХ.
Водород может применяться в различных видах транспорта – автомобилях, складском транспорте, поездах, авиатранспорте, судах – как в топливных элементах, так и в двигателях внутреннего сгорания.
 Молекула водорода
Молекула водорода
Источник: vistapointe.net
Настоящее и будущее водородной энергетики
По оценкам экспертов, мировой спрос на чистый водород в настоящее время находится на уровне 75 млн тонн в год. При этом порядка 95 % потребления приходится на нефтеперерабатывающую и химическую промышленность, в основном самостоятельно обеспечивающих собственные потребности в водороде за счет его производства на специализированных установках непосредственно в месте потребления (так называемый кэптивный рынок). Еще около 42 млн тонн водорода используется в смеси с другими газами (в основном в виде синтез-газа) в качестве сырья или топлива при производстве тепловой и электрической энергии.
Для сравнения, в качестве энергоносителя в таких перспективных сферах как транспорт и энергетика в настоящее время потребляется менее 0,01 млн тонн в год. Столь незначительные объемы во многом связаны с сохраняющимися барьерами развития водородной энергетики: высокой стоимостью низкоуглеродного водорода, недостаточной готовностью технологий для его широкого применения, включая обеспечение безопасности всей производственной цепочки, дефицитом необходимой инфраструктуры для хранения и транспортировки водорода, а также рядом пробелов в нормативной правовой базе.
На сегодняшний день наиболее экономически выгодным является производство водорода из ископаемого сырья. По данным МЭА, в структуре мирового производства чистого водорода 75 % приходится на природный газ, 23 % – на уголь. При этом водород, производящийся из ископаемого сырья (в первую очередь, угля) обладает относительно высоким углеродным следом. Для снижения углеродного следа и дальнейшей декарбонизации отраслей возможно внедрение технологий производства водорода из ископаемого сырья с использованием систем улавливания и хранения углекислого газа, а также электролиза воды, в первую очередь, с помощью энергии объектов атомной, гидро-, ветряной и солнечной энергетики. Большие перспективы имеются у новых технологий низкоуглеродного производства водорода, в частности технологии пиролиза метана.
В настоящее время мировые эксперты не пришли к единому мнению о потенциальных объемах мирового рынка водорода. Диапазон оценок глобального спроса на водород к 2050 году колеблется в пределах от нескольких десятков до почти 700 млн тонн в год. Между собой конкурируют два возможных сценария дальнейшего развития водородной энергетики: формирование глобального рынка с крупнотоннажными перевозками энергоресурса от центров производства к центрам потребления, по аналогии с рынками нефти и сжиженного природного газа, или же локальное сосредоточение производства и потребления водорода в рамках отдельных стран или небольших регионов.
По какому сценарию пойдет дальнейшее развитие водородной энергетики, будет во многом зависеть от темпов декарбонизации мировой экономики и скорости освоения и развития водородных технологий. Способствовать появлению глобального рынка водорода будет спрос со стороны стран, ратифицировавших Парижское климатическое соглашение, но не имеющих достаточных собственных ресурсов для производства низкоуглеродной энергии и топлива для декарбонизации секторов экономики. Еще одним немаловажным стимулом, способным увеличить объемы производства и потребления водорода, является развитие технологий для его использования в качестве средства накопления энергии на установках ВИЭ и расширение сфер применения водородных топливных элементов.
Развитие водородной энергетики в России
В 2019 году Россия присоединилась к Парижскому соглашению по климату, чем поддержала международные усилия по противодействию изменению климата, охране окружающей среды и рациональному природопользованию.
Уже сегодня страна является одним из гарантов глобальной энергетической безопасности, обеспечивая природным газом – наиболее экологическим чистым ископаемым источником энергии – европейских и восточных партнеров.
Одна из ключевых задач, закрепленных в Энергетической стратегии Российской Федерации на период до 2035 года, – на основе имеющихся компетенций в сфере традиционной энергетики развивать потенциал России в новых перспективных направлениях, формируя собственную научную и техническую базу энергетики будущего и наращивая экспорт высокотехнологичных решений и несырьевой продукции. В этой связи развитие водородной энергетики полностью отвечает поставленным задачам.
 Одним из первых самолетов на водороде стал советский ТУ-155
Одним из первых самолетов на водороде стал советский ТУ-155
Источник: jetphotos.com
Несмотря на то, что отечественные топливно-энергетический и электроэнергетические балансы сегодня являются одними из самых «зеленых» в мире, Россия продолжает дальнейшую работу над развитием альтернативных источников, в том числе над расширением использования водорода на внутреннем рынке.
В качестве наиболее перспективных направлений в настоящее время рассматривается применение водорода в качестве энергоносителя на транспорте, в энергетике и промышленности. Помимо этого, водород потенциально может использоваться для энергоснабжения потребителей энергетически изолированных районов и территорий с особыми требованиями экологичности, например, в Арктике.
Наша страна обладает важными конкурентными преимуществами: значительным энергетическим потенциалом и ресурсной базой, генерирующими мощностями, географической близостью к потенциальным потребителям водорода, научным заделом в сфере производства, транспортировки и хранения водорода, а также действующей транспортной инфраструктурой.
Для реализации имеющегося в стране потенциала в октябре 2020 года правительством была утверждена дорожная карта по развитию водородной энергетики в Российской Федерации до 2024 года, задача которой – расширение производства и потребления водорода, а также вхождение страны в число мировых лидеров по его производству и экспорту. В настоящее время подготовлен проект Концепции развития водородной энергетики, в котором сформулированы приоритеты развития водородной энергетики с определением краткосрочных, среднесрочных и долгосрочных целей.
Одной из первостепенных задач, на которой предстоит сосредоточиться, должна стать разработка конкурентоспособных технологий производства водорода как из ископаемого сырья, в первую очередь природного газа, так и электролизом воды на базе АЭС и ВИЭ. При этом, нужно продолжать работу по развитию в стране возобновляемой энергетики, уделяя особое внимание снижению стоимости, получаемой от солнечных и ветровых станций электроэнергии, для организации экономически эффективного производства водорода с минимальным углеродным следом.
 Использование водорода на НПЗ в Германии
Использование водорода на НПЗ в Германии
Источник: pressebox.de
Отдельное внимание стоит обратить на разработку технологий эффективной и безопасной транспортировки и хранения водорода, не получивших в настоящее время достаточного развития для широкомасштабного применения в промышленности. Для достижения эффективных результатов потребуется развитие отечественной научной школы и профессиональных кадровых компетенций, создание инжиниринговых центров и полигонов для отработки пилотных проектов, а также разработка соответствующей нормативной базы по стандартизации и в сфере безопасности по всей цепочке жизненного цикла от производства до применения водородных энергоносителей. Для вывода на рынок новых решений необходимо будет обеспечить и законодательную поддержку водородной энергетики.
Развитие всех этих направлений предусмотрено в рамках дорожной карты по развитию водородной энергетики. К 2024 году запланирована реализация ряда пилотных проектов в области водородной энергетики, направленных, в том числе, на создание и применение пилотных установок производства водорода без выбросов углекислого газа, разработку, изготовление и проведение испытаний газовых турбин на метано-водородном топливе, создание опытного образца железнодорожного транспорта на водороде и опытных полигонов низкоуглеродного производства водорода на объектах переработки углеводородного сырья или добычи природного газа, производство водорода с использованием атомных электрических станций.
Международное сотрудничество
В активной стадии находится взаимодействие с иностранными партнерами в сфере водородной энергетики. В первую очередь, ставка будет делаться на страны Европейского союза и Азиатско-Тихоокеанского региона, в которых уже приняты долгосрочные программы развития водородной энергетики.
В настоящий момент наиболее интенсивный диалог ведется с немецкой и японской сторонами. В рамках Российско-Японского Консультационного энергетического совета достигнуты принципиальные договоренности о взаимодействии в рамках двусторонней рабочей группы. Отдельное внимание уделяется перспективам сотрудничества по водородному направлению между российскими компаниями и японскими органами власти.
В частности, одна из крупнейших энергетических компаний России – «Росатом» – в рамках подписанного в 2019 году соглашения о сотрудничестве совместно с Агентством по природным ресурсам и энергетике Японии разрабатывает технико-экономическое обоснование (ТЭО) проекта поставок водорода из России в Японию. В случае его успеха можно будет говорить о реализации масштабного проекта организации глобальной цепочки поставок водорода, а в будущем – о формировании уникального низкоуглеродного водородного кластера, цена на водород в котором будет интересна для потенциальных партнеров. Еще одним перспективным направлением сотрудничества двух сторон может стать обмен опытом в части развития технологий.
Что касается российско-германского сотрудничества, в высокой степени готовности находится подписание совместной российско-германской декларации о намерениях между Минэнерго России и Федеральным Министерством экономики и энергетики ФРГ о сотрудничестве в сфере устойчивой энергетики. Предусматривается создание рабочей группы высокого уровня по устойчивой энергетике под председательством министров энергетики России и Германии и входящей в ее состав подгруппы по сотрудничеству в сфере водородной энергетики.
 Южнокорейская Hyundai активно развивает производство машин на водороде и заправочные станции для них
Южнокорейская Hyundai активно развивает производство машин на водороде и заправочные станции для них
Источник: hyundai.com
Подписание Декларации станет основой для расширения взаимовыгодного энергетического сотрудничества между нашими странами, обмена опытом в области изучения технологии производства, хранения, использования и транспортировки водорода для реализации совместных российско-германских проектов в данной сфере, а также будет способствовать использованию и совершенствованию наилучших доступных технологий и практик.
На сегодняшний день энергетическая политика Российской Федерации полностью отражает ключевые мировые тренды. Наша страна на протяжении многих лет является одним из лидеров на глобальном рынке углеводородов, при этом параллельно, не теряя, а наращивая компетенции в традиционных направлениях ТЭК, Россия намерена войти в число мировых лидеров в сфере производства и экспорта водорода. Это окажет мультипликативный эффект на развитие смежных отраслей и будет способствовать достижению глобальной цели низкоуглеродного развития мировой экономики.
Водород: физические и химические свойства

Если кислород является самым распространенным химическим элементом на Земле, то водород – самый распространенный элемент во всей Вселенной. Наше Солнце (и другие звезды) примерно на половину состоит из водорода, а что касается межзвездного газа, то он на 90% состоит из атомов водорода. Немалое место этот химический элемент занимает и на Земле, ведь вместе с кислородом он входит в состав воды, а само его название «водород» происходит от двух древнегреческих слов: «вода» и «рожаю». Помимо воды водород присутствует в большинстве органических веществ и клеток, без него, как и без кислорода, была бы немыслима сама Жизнь.
История открытия
Первым среди ученых водород заметил еще великий алхимик и лекарь средневековья Теофраст Парацельс. В своих алхимических опытах, в надежде отыскать «философский камень» смешивая металлы с кислотами Парацельс получил некий неизвестный до того горючий газ. Правда отделить этот газ от воздуха так и не удалось.
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом. Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.
В 1766 году Кавендишу удалось получить чистый водород, который он называл «горючим воздухом». Еще через 20 лет талантливый французский химик Антуан Лавуазье смог синтезировать воду и выделить из нее этот самый «горючий воздух» – водород. И к слову именно Лавуазье предложил водороду его название – «Hydrogenium», он же «водород».

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему. Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы
Водород это газ, молекула его состоит из двух атомов.
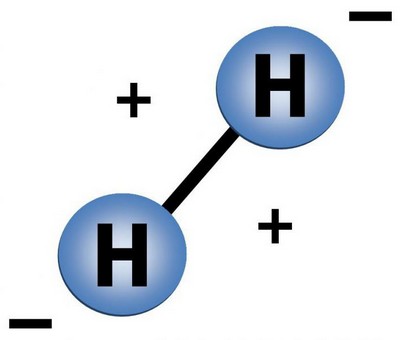
Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Практическое применение
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Водород: история и использование

Водород: история и использование
История и использование водорода
Склонность водорода к сгоранию делает его опасным химическим элементом и полезным источником энергии.
Водород является самым простым и наиболее распространенным из химических элементов, которые являются составными частями многих вещества. Другие атомы состоят из протонов, нейтронов и электронов. Но водород имеет только один электрон и один протон. Это также самый распространенный элемент, фактически, водород составляет около трех четвертей всего вещества во вселенной.
Водород является бесцветным газом без запаха. В своей наиболее распространенной форме он чрезвычайно горюч, другими словами, он имеет тенденцию вспыхивать и эта тенденция делает водород и очень опасным и в то же время очень полезным в области энергообеспечения.
Энергия: Водород — топливо будущего!
Когда был открыт водород?
Источник: ВикипедиЯ
Водород был впервые обнаружен в 1671 году британским ученым Робертом Бойлом. Он экспериментировал с разными металлами, погружая их в кислоту. Когда чистый металл помещают в кислоту, происходит тип реакции, называемый реакцией однократного вытеснения. Например, добавление калия (K) в раствор соляной кислоты (HCl) вызывает следующую реакцию: 2K + 2HCl → 2KCl + H2
Калий реагирует с кислотой, что вызывает образование соли, называемой хлоридом калия. Между тем, оставшиеся атомы водорода объединяются в газообразный водород.
Источник: ВикипедиЯ
В газете 1776 года британский ученый по имени Генри Кавендиш подтвердил, что водород является очень интересным элементом. И Бойл, и Кавендиш заметили, что газообразный водород очень легко воспламеняется. В частности, он быстро и сильно подвергается реакции горения с кислородом.
2H2 + O2 → 2H2O (+ тепло)
Реакция берет молекулы водорода и кислорода и объединяет их вместе, чтобы сформировать H2O (вода). Эта реакция экзотермическая. Это означает, что он генерирует тепловую энергию. Другие ученые позже обнаружат, что водород обеспечивает топливо для реакций ядерного синтеза, которые происходят внутри звезд. Эти реакции синтеза производят весь свет и тепло, которые производят Солнце и другие звезды.
Что такое водород?
Для чего использовался водород в прошлом?
Наряду с его воспламеняемостью, Бойл и Кавендиш также отметили, что водород менее плотен (легче), чем воздух. Водород отлично поднимает такие предметы, как воздушные шары. Таким образом, он похож на второй самый простой элемент, гелий. На самом деле, водород даже лучше поднимает вещи, чем гелий. Таким образом, это был только вопрос времени, когда люди начали проектировать заполненные водородом воздушные шары для транспортировки.
К началу 1900-х годов большие воздушные корабли, которые использовали водород в качестве подъемного газа, стали популярной формой воздушных путешествий.
Однако увлечение дирижаблем, заполненным водородом, длилось недолго. В 1937 году произошла трагедия в США. Немецкий дирижабль Гинденбург загорелся и взорвался в Лейкхерсте, штат Нью-Джерси, убив 36 человек, кроме того в мире происходило много трагических случаев в которых фигурировал дирижабль.
Разработчики дирижаблей знали, что водород легко воспламеняется и что гелий был более безопасным выбором. Однако гелий был редким и дорогим газом. И именно поэтому они пошли более дешевым, но менее безопасным вариантом. После катастрофы дирижабля от взрыва водорода, от него как от подъёмного газа быстро отказались, а на смену дирижабля пришёл становящийся всё более распространенным самолёт.
1937 г. — Катастрофа германского дирижабля
Для чего использовался H2 совсем недавно?
Наверное, многие видели видео запуска космического челнока или стыковки на Международной космической станции. Эта программа была отменена в 2011 году. Но до тех пор шаттл был для астронавтов НАСА главным способом полета в космос. Вы никогда не задумывались, что приводило в действие эти невероятно огромные двигатели? Это был водород!
Главный двигатель космического челнока приводился в действие сжиганием жидкого водорода и жидкого кислорода. Сколько энергии обеспечивает сжигание водорода? Так много, что трудно представить! Работающие вместе три двигателя «Спейс Шаттл» вырабатывают примерно столько же энергии, сколько 120 железнодорожных локомотивов.
Инженеры НАСА также поняли, насколько опасным может быть водород. Однако они решили, что могут воспользоваться всей этой необузданной силой, если будут очень осторожны.
В последнее время люди проявляют все больший интерес к снижению своего воздействия на окружающую среду. Один из способов сделать это — прекратить сжигать топливо для питания автомобилей. Существует большой интерес к разработке автомобилей на водородных топливных элементах. Преимущество использования водорода для заправки автомобилей заключается в том, что в отличие от бензина, отходы — это не парниковый газ, а вода!
Машина на водородном двигателе: плюсы и минусы
В отличие от дирижабля, автомобили, работающие на водороде, не должны быть сверхлегкими, как воздушные шары, поэтому топливо сжимается и хранится в очень жестких баках, чтобы предотвратить утечки. Лучшим решением было бы хранить топливо как твердое вещество, а не как газ. Материал все еще может сгореть в результате несчастного случая. Однако вряд ли он взорвется. Риск пожара при авариях примерно такой же, как и у автомобиля с бензиновым двигателем.
Водородные топливные элементы. Как это сделано
Но одной из основных проблем использования водорода в качестве источника топлива для автомобилей является хранение. Водород имеет больше энергии, чем бензин по весу, но он имеет меньше энергии по объему. Это означает, что нужен довольно большой бак с водородным газом, чтобы проехать на автомобиле достаточное расстояние, прежде чем заправляться. Бензобаки большинства автомобилей слишком малы, чтобы хранить достаточно газообразного водорода для передвижения в городских условиях или более дальних поездок.
Ученые изучают возможность превращения водорода из газа в твердое вещество. Причиной этого является низкая плотность энергии. Когда водород поглощается твердым химическим веществом, он может получить более высокую плотность энергии. Академические, отраслевые и правительственные исследователи ищут этот инновационный способ выведения водорода на передний план энергетической экономики.
Человеческое понимание водорода прошло долгий путь с момента его открытия в 1671 году. Он использовался для подъема дирижаблей и доставки людей в космос, а сегодня он уже является источником энергии питающей автомобили завтрашнего дня!
Полезной ли оказалась для вас эта статья? Напишите ваше мнение в комментариях!
Водород (Hydrogene, H)
В периодической системе водород располагается в двух абсолютно противоположных по своим свойствам группах элементов. Данная особенность делают его совершенно уникальным. Водород не просто представляет собой элемент или вещество, но также является составной частью многих сложных соединений, органогенным и биогенным элементом. Поэтому рассмотрим его свойства и характеристики более подробно.
История открытия водорода

Выделение горючего газа в процессе взаимодействия металлов и кислот наблюдали еще в XVI веке, то есть во время становления химии как науки. Известный английский ученый Генри Кавендиш исследовал вещество, начиная с 1766 года, и дал ему название «горючий воздух». При сжигании этот газ давал воду. К сожалению, приверженность ученого теории флогистона (гипотетической «сверхтонкой материи») помешала ему прийти к правильным выводам.
Французский химик и естествоиспытатель А. Лавуазье вместе с инженером Ж. Менье и при помощи специальных газометров в 1783 г. провел синтез воды, а после и ее анализ посредством разложения водяного пара раскаленным железом. Таким образом, ученые смогли прийти к правильным выводам. Они установили, что «горючий воздух» не только входит в состав воды, но и может быть получен из нее.
В 1787 году Лавуазье выдвинул предположение, что исследуемый газ является простым веществом и, соответственно, относится к числу первичных химических элементов. Он назвал его hydrogene (от греческих слов hydor — вода + gennao — рождаю), т. е. «рождающий воду».
Русское название «водород» в 1824 году предложил химик М. Соловьев. Определение состава воды ознаменовало конец «теории флогистона». На стыке XVIII и XIX веков было установлено, что атом водорода очень легкий (по сравнению с атомами прочих элементов) и его масса была принята за основную единицу сравнения атомных масс, получив значение, равное 1.
Физические свойства

Водород является легчайшим из всех известных науке веществ (он в 14,4 раз легче воздуха), его плотность составляет 0,0899 г/л (1 атм, 0 °С). Данный материал плавится (затвердевает) и кипит (сжижается), соответственно, при -259,1 °С и -252,8 °С (только гелий обладает более низкими t° кипения и плавления).
Критическая температура водорода крайне низка (-240 °С). По этой причине его сжижение — довольно сложный и затратный процесс. Критическое давление вещества — 12,8 кгс/см², а критическая плотность составляет 0,0312 г/см³. Среди всех газов водород имеет наибольшую теплопроводность: при 1 атм и 0 °С она равняется 0,174 вт/(мхК).
Удельная теплоемкость вещества в тех же условиях — 14,208 кДж/(кгхК) или 3,394 кал/(гх°С). Данный элемент слабо растворим в воде (около 0,0182 мл/г при 1 атм и 20 °С), но хорошо — в большинстве металлов (Ni, Pt, Pa и прочих), особенно в палладии (примерно 850 объемов на один объем Pd).
С последним свойством связана его способность диффундирования, при этом диффузия через углеродистый сплав (к примеру, сталь) может сопровождаться разрушением сплава из-за взаимодействия водорода с углеродом (этот процесс называется декарбонизация). В жидком состоянии вещество очень легкое (плотность — 0,0708 г/см³ при t° = -253 °С) и текучее (вязкость — 13,8 спуаз в тех же условиях).
Химические свойства водорода

Во многих соединениях этот элемент проявляет валентность +1 (степень окисления), подобно натрию и прочим щелочным металлам. Обычно он рассматривается в качестве аналога этих металлов. Соответственно он возглавляет I группу системы Менделеева. В гидридах металлов ион водорода проявляет отрицательный заряд (степень окисления при этом -1), то есть Na+H- имеет структуру, подобную хлориду Na+Cl-. В соответствии с этим и некоторыми другими фактами (близость физических свойств элемента «H» и галогенов, способность его замещения галогенами в органических соединениях) Hydrogene относят к VII группе системы Менделеева.
В обычных условиях молекулярный водород имеет низкую активность, непосредственно соединяясь только с самыми активными из неметаллов (с фтором и хлором, с последним — на свету). В свою очередь, при нагревании он взаимодействует со многими химическими элементами.
Атомарный водород имеет повышенную химическую активность (если сравнивать с молекулярным). С кислородом он образует воду по формуле:
выделяя 285,937 кДж/моль тепла или 68,3174 ккал/моль (25 °С, 1 атм). В обычных температурных условиях реакция протекает довольно медленно, а при t° >= 550 °С — неконтролируемо. Пределы взрывоопасности смеси водород + кислород по объему составляют 4–94 % Н₂, а смеси водород + воздух — 4–74 % Н₂ (смесь из двух объемов Н₂ и одного объема О₂ называют гремучим газом).
Данный элемент используют для восстановления большинства металлов, так как он отнимает кислород у оксидов:
CuO + H₂ = Cu + H₂O и т. д.
С разными галогенами водород образует галогеноводороды, к примеру:
Однако при реакции с фтором водород взрывается (это происходит и в темноте, при -252 °С), с бромом и хлором реагирует только при нагревании или освещении, а с йодом — исключительно при нагревании. При взаимодействии с азотом образуется аммиак, но лишь на катализаторе, при повышенных давлениях и температуре:
При нагревании водород активно реагирует с серой:
и значительно труднее — с теллуром или селеном. С чистым углеродом водород реагирует без катализатора, но при высоких температурах:
2Н₂ + С (аморфный) = СН₄ (метан).
Данное вещество непосредственно реагирует с некоторыми из металлов (щелочными, щелочноземельными и прочими), образуя гидриды, например:
Немаловажное практическое значение имеют взаимодействия водорода и оксида углерода (II). При этом в зависимости от давления, температуры и катализатора образуются разные органические соединения: НСНО, СН₃ОН и пр. Ненасыщенные углеводороды в процессе реакции переходят в насыщенные, к примеру:
Водород и его соединения играют в химии исключительную роль. Он обусловливает кислотные свойства т. н. протонных кислот, склонен образовывать с разными элементами водородную связь, оказывающую значительное влияние на свойства многих неорганических и органических соединений.
Получение водорода
Основными видами сырья для промышленного производства этого элемента являются газы нефтепереработки, природные горючие и коксовые газы. Его также получают из воды посредством электролиза (в местах с доступной электроэнергией). Одним из важнейших методов производства материала из природного газа считается каталитическое взаимодействие углеводородов, в основном метана, с водяным паром (т. н. конверсия). Например:
Неполное окисление углеводородов кислородом:
Синтезированный оксид углерода (II) подвергается конверсии:
Водород, производимый из природного газа, является самым дешевым.
Для электролиза воды применяется постоянный ток, который пропускается через раствор NaOH или КОН (кислоты не используют во избежание коррозии аппаратуры). В лабораторных условиях материал получают электролизом воды или в результате реакции между соляной кислотой и цинком. Однако чаще применяют готовый заводской материал в баллонах.
Из газов нефтепереработки и коксового газа данный элемент выделяют путем удаления всех остальных компонентов газовой смеси, так как они легче сжижаются при глубоком охлаждении.
Применение водорода

Промышленным образом этот материал стали получать еще в конце XVIII века. Тогда его использовали для наполнения воздушных шаров. На данный момент водород широко применяют в промышленности, главным образом — в химической, для производства аммиака.
Массовые потребители вещества — производители метилового и прочих спиртов, синтетического бензина и многих других продуктов. Их получают синтезом из оксида углерода (II) и водорода. Hydrogene используют для гидрогенизации тяжелого и твердого жидкого топлива, жиров и пр., для синтеза HCl, гидроочистки нефтепродуктов, а также в резке/сварке металлов. Важнейшими элементами для атомной энергетики являются его изотопы — тритий и дейтерий.
Биологическая роль водорода
Около 10 % массы живых организмов (в среднем) приходится на этот элемент. Он входит в состав воды и важнейших групп природных соединений, включая белки, нуклеиновые кислоты, липиды, углеводы. Для чего он служит?
Этот материал играет решающую роль: при поддержании пространственной структуры белков (четвертичной), в осуществлении принципа комплиментарности нуклеиновых кислот (т. е. в реализации и хранении генетической информации), вообще в «узнавании» на молекулярном уровне.
Ион водорода Н+ принимает участие в важных динамических реакциях/процессах в организме. В том числе: в биологическом окислении, которое обеспечивает живые клетки энергией, в реакциях биосинтеза, в фотосинтезе у растений, в бактериальном фотосинтезе и азотфиксации, в поддержании кислотно-щелочного баланса и гомеостаза, в мембранных процессах транспорта. Наряду с углеродом и кислородом он образует функциональную и структурную основы явлений жизни.
Водород — самый маленький и распространённый элемент во Вселенной
Представьте себе, человек включает в сеть прибор, опускает его в колбу с водой и по всему дому загораются лампочки, работают электроплита и стиральная машина. И в результате работы прибора отходами является вода, которую завтра вновь можно использовать. Фантастика? Не совсем. В мировых лабораториях ученые работают над получением альтернативного топлива. И водородное топливо — одно из наиболее перспективных в этом плане.
Сейчас, когда вещества окружающего мира разложены на атомы, а человек стремится заглянуть внутрь ядра, водород и другие газы хорошо изучены. Древние алхимики, из-за невидимости газов, не учитывали участие воздуха в проводимых реакциях. И только со временем к ученым пришло понимание, что воздушные газы — полноценные участники химических реакций, и без их исследования картина мира будет неполной.
У истоков завтрашних изобретений стоят исследования ученых XVI-XVII вв и теория о флогистоне — некой горючей субстанции, что улетучивается из веществ при горении, смешивается с воздухом и не может быть выделена из него.
В 1703 году теория флогистона описана немецким ученым Георгом Шталем для объяснения процессов горения, восстановления и обжига.
Первооткрывателем водорода считают, Генри Кавендиша, который подробно исследовал вещество, названное им «горючий воздух». Профиль ученого можно увидеть на странице 72 учебника «Химия 8 класс» под редакцией Н.Е.Кузнецовой. Более точных портретов ученого к сожалению не осталось. Современники описывали его как очень скромного и странного человека.
Лавуазье во второй половине восемнадцатого века осуществили водный синтез водорода с помощью горячего железа, что доказало присутствие водорода в составе воды.
Водород (Hydrogenium) — рождающий воду. Обозначается латинской литерой Н. Вселенная на 75% состоит из водорода, и на остальные 93 природных элемента, присутствующих в таблице Менделеева приходятся остальные 25%. На Земле — его позиция скромнее, девятый по распространенности. Водород входит в состав воды, благодаря круговороту которой поддерживается жизнь на земле.
Физические свойства водорода
не обладает цветом,
не ощутим вкусовыми и обонятельными рецепторами человека ( NB! Помним, что пробовать в лаборатории ничего нельзя!)
кипит и плавится при отрицательных температурах. (-252,6 0С и -259,2 0С соответственно);
в сравнении с воздухом, водород легче практически в 14 раз;
из-за неполярности молекулы Н2, водород плохо растворим в воде,
некоторые металлы (палладий) могут абсорбировать атомарный водород с образованием гидридов металлов..
Если внимательно посмотреть на Периодическую таблицу Д.И.Менделеева на последнем форзаце учебника «Химия 8 класс» под редакцией Н.Е.Кузнецовой можно заметить что водород есть и в первой группе и в седьмой. Такое расположение обусловлено тем, что в одних условиях водород -донор электрона и реагирует как металл, а в других акцептор электрона и проявляет свойства неметаллов.
Формулы получения водорода
1. Реакция металлов с разбавленными кислотами:
Zn +2HCl → ZnCl2 +H2↑
Для получения водорода используется аппарат Киппа. Представлен на странице 73 учебника “Химия 8 класс” под редакцией Н.Е.Кузнецовой
2. Реакция щелочных и щелочноземельных металлов с водой:
2Na +2H2O → 2NaOH +H2↑
3. Реакции гидролиза гидридов:
NaH +H2O → NaOH +H2↑
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
4.Реакции цинка, кремния или алюминия со щелочами:
2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
5. Электролиз воды.
2H2O → 2H2+О2
Не смотря на то, что в результате электролиза получается чистый водород, экономически этот способ самый дорогой.

1. Взаимодействие с галогенами.
При обычной температуре водород реагирует со фтором:
H2 + F2 = 2HF.
Яркий свет обеспечивает реакцию водорода с хлором с выделением хлороводорода, взаимодействие с бромом протекает не так активно, водород с йодом не реагирует до конца даже при высокой температуре.
2. Взаимодействие с кислородом.
Горение водорода в кислороде — экзотермическая реакция. Температура водородно-кислородного пламени достигает почти 3000 °С.
Для получения сероводорода пропускают водород через расплавленную серу:
H2 + S = H2S
4.Химические свойства водорода с оксидами металлов.
Благодаря способности водорода отдавать электроны, он восстанавливает многие металлы из их оксидов:
CuO + H2 = Cu + H2O.
5. Химические свойства металлов с водородом.
Если водород нагреть до высокой температуры, происходит реакция с щелочными и щелочноземельными металлами.




