Вода как замерзает
Вода как замерзает
Почему вода замерзает? Описание, фото и видео

Силы и частицы
Вода – это вещество, которое может наблюдаться в трех агрегатных состояниях. Она может замерзать и быть твердым льдом, она бывает в жидкой форме, и также она присутствует в виде пара – не только в бане, но и в небе, в виде облаков. Однако в рамках данной статьи остановимся на первом ее состоянии, твердом.
Вода замерзает, образуя кристаллики твердого льда. Лед может формировать многокилометровые поверхности, покрывая реки, озера и другие водоемы. При этом он оказывается легче жидкой воды и всегда находится сверху. Замерзает вода из-за понижения температур.
Температуры и агрегатное состояние веществ
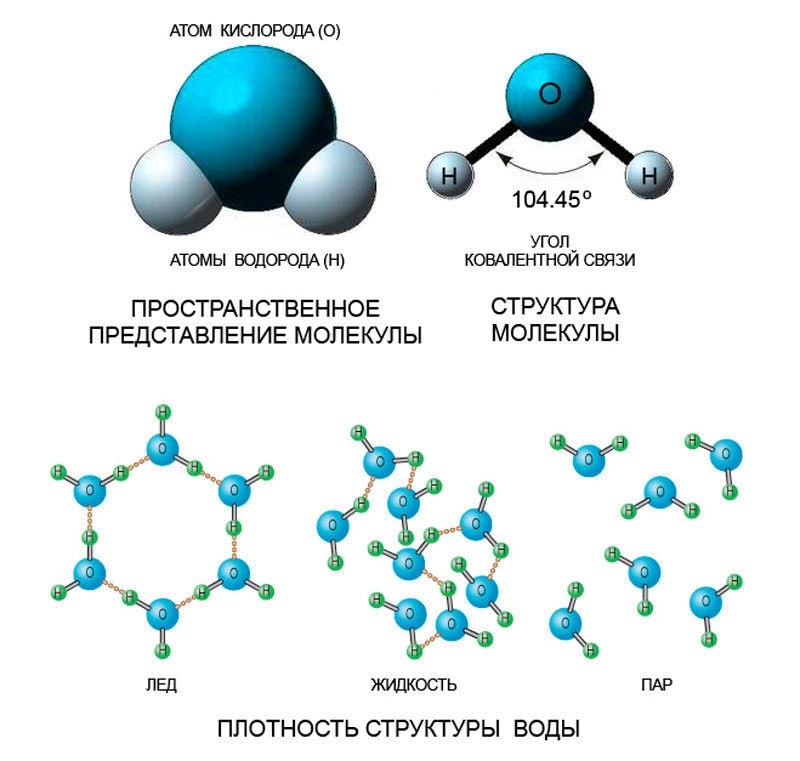
Молекула воды в различных агрегатных состояниях
Чем выше температуры, тем дальше отстоят между собой молекулы любых веществ. Их отдаление друг от друга приводит к размягчению вещества, которое сначала становится жидким, а потом и вовсе газообразным. Этот процесс можно рассмотреть на примере железа, которое плавится в тигле и обретает жидкую форму. При сильном повышении температур оно может стать и газообразным, то есть, испариться, но для этого температура должна быть по-настоящему высокой.
Вода же при обычной комнатной температуре является жидкостью. При повышении температур она станет паром, а при понижении – льдом. Ведь понижение температуры имеет обратное влияние на молекулы – они сближаются. А при их сближении вещество становится тверже, плотнее. Такого же эффекта можно добиться при механическом прессовании любого вещества- оно станет тверже, опять же из-за сближения молекул.
Что происходит при понижении температур?
Когда на воду оказывается влияние пониженных температур, молекулы сближаются, образуя шестигранные формы. Разумеется, это снежинки, которые являются кристаллами воды. Остывание воды и ее кристаллизация – это фактически синонимы, описывающие один и тот же процесс. Вода начинает кристаллизоваться при температуре в 0 градусов – именно этот момент и взят за нулевую отметку по шкале Цельсия. Если рассматривать американскую шкалу Фаренгейта, то здесь застывание воды будет происходить при 32 градусах.
Но для создания кристаллов воды нужна основа, какие-либо примеси или взвеси, благодаря которым стартует этот процесс. И если вода абсолютно чистая, здесь наблюдается несколько другое явление – порой она застывает только при -40 градусах, а при нуле и других не слишком низких отметках остается жидкой. Однако не замерзает она только в спокойном состоянии. Если ее взболтать при минусовых отметках, она немедленно превратится в лед.
Интересные факты
С водой связано множество парадоксов. И кроме уже описанного выше нюанса, необходимо отметить, что лед занимает больше объема, чем жидкая вода, то есть, при замерзании это вещество расширяется, в то время как другие наоборот занимают меньше объема при низких температурах. Именно с расширением воды при формировании льда и связано лопание бочек, труб и других объектов, оставленных на зиму заполненными водой.
На момент замерзания молекулы немного отдаляются друг от друга, что и дает такой эффект. И именно этот фактор, наряду с вмерзшими пузыриками воздуха, делает лед плавучим. Если бы он тонул или формировался со дна, ни одно живое существо в водоемах не смогло бы перезимовать. Но формируясь именно на поверхности, и оставаясь там, лед наоборот сохраняет тепло воды и выполняет защитную функцию в зимнее время, давая животным, растениям и рыбам возможность перезимовать и выжить.
Есть и другие интересные феномены. Так, практика показала, что горячая вода замерзает быстрее холодной, и это явление с удивлением наблюдали еще во времена античности. На данный момент существует несколько гипотез, объясняющих этот парадокс, но окончательного ответа так и не было найдено.
Вода – это загадочная стихия, и чем больше люди погружаются в ее изучение, тем больше необъяснимых загадок она приносит. На данный момент установлено, что она обладает памятью, может быть мертвой или живой. Она является универсальным растворителем, и имеет массу других уникальных качеств. Несмотря на ее изобилие и распространенность на нашей планете, она все еще сохраняет множество своих загадок, и с большинством из них ученым приходится только мириться. Ведь спорить с фактами затруднительно.
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Что происходит с водой при замерзании: молекулы расширяются или сжимаются?
В нашем сегодняшнем уроке мы узнаем что происходит с водой при замерзании и расширяются ли или сжимаются молекулы воды.
С приходом зимы вода начинает свой процесс расширения. Почему это происходит? Это свойство выделяет воду из списка всех остальных жидкостей и газов, которые, наоборот, сжимаются при охлаждении. В чем заключается причина такого поведения этой необычной жидкости?
Физика 3 класса: вода при замерзании расширяется или сжимается?
Большинство веществ и материалов увеличиваются в объеме при нагревании и уменьшаются при охлаждении. Газы этот эффект показывают более заметно, но различные жидкости и твердые металлы проявляют такие же свойства.

Одним из наиболее ярких примеров расширения и сжимания газа является воздух в воздушном шаре. Когда мы выносим воздушный шар на улицу в минусовую погоду, то шар сразу уменьшается в размерах. Если мы шар вносим в отапливаемое помещение, то он сразу же увеличивается. А вот если мы внесем воздушный шар в баню — он лопнет.
Молекулы воды требуют больше места
Причиной тому, что происходят эти процессы расширения и сжатия различных веществ, являются молекулы. Те из них, которые получают больше энергии (это происходит в теплом помещении), двигаются намного быстрее, чем молекулы, находящиеся в холодном помещении. Частицы, которые имеют большую энергию, сталкиваются намного активнее и чаще, им необходимо больше места для движения. Чтобы сдержать то давление, которое оказывают молекулы, материал начинает увеличиваться в размерах. Причем это происходит достаточно стремительно. Итак, вода при замерзании расширяется или сжимается? Почему это происходит?
Вода не подчиняется этим правилам. Если мы начинаем охлаждать воду до четырех градусов Цельсия, то она уменьшает свой объем. Но если температура продолжает падать, то вода вдруг начинает расширяться! Существует такое свойство, как аномалия плотности воды. Это свойство возникает при температуре в четыре градуса Цельсия.

Теперь, когда мы выяснили, расширяется или сжимается вода при замерзании, давайте узнаем, как вообще возникает эта аномалия. Причина таится в частицах, из которых она состоит. Молекула воды создана из двух атомов водорода и одного — кислорода. Формулу воды все знают еще с начальных классов. Атомы в этой молекуле притягивают электроны по-разному. У водорода создается положительный центр тяжести, а у кислорода, наоборот — отрицательный. Когда молекулы воды сталкиваются друг с другом, то атомы водорода одной молекулы переходят на атом кислорода совершенно другой молекулы. Этот феномен называется водородной связью.
Воде нужно больше места при ее охлаждении
В тот момент, когда начинается процесс формирования водородных связей, в воде начинают возникать места, где молекулы находятся в том же порядке, что и в кристалле льда. Эти заготовки называются кластерами. Они не прочны, как в твердом кристалле воды. При повышении температуры они разрушаются и меняют свое местоположение.
Во время процесса охлаждения воды начинает стремительно увеличиваться количество кластеров в жидкости. Они требуют больше пространства для распространения, вследствие этого вода и увеличивается в размерах после достижения своей аномальной плотности.

При падении столбика термометра ниже нуля кластеры начинают превращаться в мельчайшие кристаллы льда. Они начинают подниматься вверх. Вследствие всего этого вода превращается в лед. Это очень необычная способность воды. Данный феномен необходим для очень большого количества процессов в природе. Мы все знаем, а если не знаем, то запоминаем, что плотность льда незначительно меньше плотности прохладной или же холодной воды. Благодаря этому лед плавает на поверхности воды. Все водоемы начинают замерзать сверху вниз, что позволяет спокойно существовать и не замерзать водным обитателям на дне. Итак, теперь мы в подробностях знаем о том, расширяется или сжимается вода при замерзании.
Интересный феномен
Горячая вода замерзает быстрее холодной. Если мы возьмем два одинаковых стакана и нальем в один горячей воды, а в другой столько же холодной, то мы заметим, что горячая вода замерзнет быстрее, чем холодная. Это не логично, согласитесь? Горячей воде нужно остыть, чтобы начинать замерзать, а холодной этого не нужно. Как объяснить данный факт? Ученые по сей день не могут объяснить эту загадку. Данный феномен имеет название «Эффект Мпембы». Открыт был в 1963 году ученым из Танзании при необычном стечении обстоятельств. Студент хотел сделать себе мороженое и заметил, что горячая вода замерзает быстрее. Об этом он поделился со своим учителем физики, который сначала не поверил ему.
Еще одно объяснение эффекта Мпембы (это про почему кипяток замерзает быстрее холодной воды)
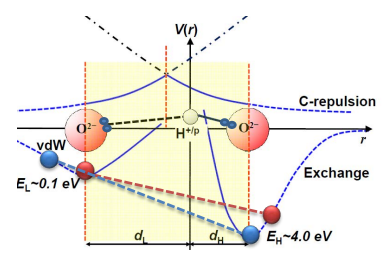
Краткое содержание: из-за наличия водородных связей в молекулах воды происходит изменение конфигурации ковалентных связей О-Н, с запасанием в них дополнительной энергии, выделяющейся при охлаждении и работающей как дополнительный подогрев, мешающий замерзанию. В горячей воде водородные связи растянуты, ковалентные не напряжены, запас энергии мал- остывание и замерзание идет быстрее. Существует некоторое характерное время tau, необходимое на формирование водородных связей, если процесс охлаждения будет идти медленно- то эффект Мпембы исчезнет. Если процесс охлаждения идет относительно быстро (до десятков минут)- то эффект выражен. Вероятно, должна быть и какая-то критическая температура, начиная с которой эффект появляется, но в статье это не отражено.
На КДПВ приведено изображение из оригинальной статьи, глядя на которое читатель должен со всей ясностью увидеть, что в ковалентных связях запасается энергия, которая затем может выделяться в виде дополнительного тепла, мешая остывать холодной воде.
История вопроса
Аристотель первым отметил, что горячая вода замерзает быстрее холодной, но химики всегда отказывались объяснять этот парадокс. До сегодняшнего дня.
Вода одно из самых обычных веществ на Земле, но в тоже время одно из самых загадочных. Например, как и у большинства жидкостей, ее плотность растет при охлаждении. Однако, в отличие от остальных, ее плотность достигает максимума при температуре 4С, а затем начинает уменьшаться вплоть до температуры кристаллизации.
В твердой фазе вода имеет несколько меньшую плотность, из-за чего лед плавает на поверхности воды. Это одна из причин существования жизни на Земле — если бы лед был плотнее воды, то при замерзании он опускался бы на дно озер и океанов, что сделало бы невозможным многие типы химических процессов, которые делают жизнь возможной.
Итак, существует странный эффект Мпембы, названный в честь танзанийского студента, который обнаружил, что горячая смесь для мороженого замерзает быстрее, чем холодная в морозилке школьной кухни где-то в начале 1960-х. (На самом деле этот эффект отмечался множеством исследователей в истории, начиная с Аристотеля, Фрэнсиса Бэкона и Рене Декарта).
Эффект Мпембы заключается том, что горячая вода замерзает быстрее холодной. Этот эффект измерялся во множестве случаев с различными объяснениями, изложенными далее. Одна из идей заключается в том, что горячие сосуды имеют лучший тепловой контакт с морозильной камерой и отводят тепло более эффективно. Другая- в том, что теплая вода испаряется быстрее, а так как этот процесс- эндотермический (идет с поглощением теплоты)- то он ускоряет замерзание.
Ни одно из этих объяснений не выглядит правдоподобным, поэтому реальное объяснение до сих пор отсутствовало.
Новое объяснение эффекта (теперь-то уж точно правильное)
Сегодня Зи Чанг из Наньянгского технологического университета Сингапура и несколько его коллег предоставили таковое. Эти ребята утверждают, что эффект Мпембы является результатом уникальных свойств различных типов связи, удерживающих молекулы воды вместе.
Так что же такого в этих связях? Каждая молекула воды состоит из сравнительно большого атома кислорода, соединенного с двумя маленькими атомами водорода обычной ковалентной связью. Но если поместить рядом несколько молекулы воды, то водородные связи тоже начнут играть важную роль. Это происходит из-за того, что атомы водорода одной молекулы располагаются вблизи кислорода другой молекулы, и взаимодействуют с ним. Водородные связи намного слабее ковалентных (прим. пер.
в 10 раз), но сильнее чем Ван-дер-Ваальсовы силы, которые использует геккон для прилипания к вертикальным стенам.
Химики давно знают о важности этих связей. Например, точка кипения воды намного выше, чем у других жидкостей с похожими молекулами, из-за того, что водородные связи удерживают молекулы вместе.
Но в последние годы химики все более интересуются другими ролями, которые могут играть водородные связи. Например, молекулы воды в тонких капиллярах формируют длинные цепочки, удерживаемые водородными связями. Это очень важно для растений, у которых испарение воды через мембраны листьев эффективно протаскивает цепь молекул воды от корней вверх.
Теперь Зи с соавторами утверждают, что водородные связи так же объясняют эффект Мпембы. Их ключевая идея состоит в том, что водородные связи приводят к более плотному контакту молекул воды, и когда это происходит, естественное отталкивание между молекулами приводит к сжатию ковалентных связей и накоплению энергии в них.
Однако, когда жидкость нагревается, расстояние между молекулами увеличивается, а водородные связи растягиваются. Это также позволяет увеличить длину ковалентных связей и таким образом- отдать обратно энергию, накопленную в них. Важным элементом теории является тот факт, что процесс, при котором ковалентные связи отдают накопленную в них энергию- эквивалентен охлаждению!
В действительности- этот эффект усиливает обычный процесс охлаждения. Таким образом, горячая вода должна охлаждаться быстрее холодной, рассуждают авторы. И это именно то, что мы наблюдаем в эффекте Мпембы.
Почему новое объяснение лучше предыдущих?
Эти ребята рассчитали величину дополнительного охлаждения, и показали, что она в точности соответствует наблюдаемой разнице в экспериментах по измерению разности скоростей охлаждения горячей и холодной воды. Вуаля! Это интересный взгляд на сложные и загадочные свойства воды, которые все еще заставляют химиков не спать по ночам. Несмотря на то, что идея Зи и соавторов убедительна, она может оказаться очередной ошибкой теоретиков, которую другие физики должны будут опровергнуть. Это оттого, что теории не хватает прогностической силы (по крайней мере- в оригинальной статье).
Зи и соавторам необходимо воспользоваться своей теорией для предсказания новых свойств воды, которые не выводятся из обычных рассуждений. Например, если ковалентные связи укорачиваются- это должно приводить к возникновению каких-то новых измеряемых свойств воды, которые не должны были бы проявляться в противном случае. Открытие и измерение таких свойств было бы последней вишенкой на торте, которой не хватает теории в ее текущем виде.
Итак, несмотря на то, что парни, возможно, неплохо объяснили эффект Мпембы, им необходимо чуток поднапрячься, чтобы убедить в этом остальных.
Какая температура замерзания воды под давлением и для чего это необходимо знать?
Многие помнят из курса школьной физики о том, что температура замерзания воды составляет 0°.
На самом деле это определение нуждается в уточнении – при условии воздействия нормального атмосферного давления. Последнее в значительной степени можно считать условной величиной.
О том, какова температура замерзания воды, находящейся под давлением, расскажем в статье.
Замерзает ли?

При атмосферном давлении в 760 мм рт.ст (или 0,101 МПа), вода превращается в лед уже при 0°С, как известно из школьного курса.
Но при уменьшении этого показателя меняется и точка кипения, и t°, при которой происходит превращение в лед – последняя как раз повышается.
В горах, где разреженный воздух, на определенной высоте она может уже составлять +2…+4°С. И наоборот, чем больше среда давит на воду, тем ниже находится точка замерзания на графиках.
Интересно, что при давлении в 611,73 Па совпадают температура кипения воды и плавления льда. Она составляет +0,01°С. Этот показатель называют тройной точкой воды из-за того, что она находится сразу в трех состояниях.
Считается, что при более низком показателе она просто не сможет сохранять жидкое состояние и будет превращаться в водяной пар. Причем температура плавления льда и точка замерзания воды обычно не совпадают, это разные величины.
Хотя для удобства бытовых расчетов их часто отождествляют, поскольку при 760 мм рт.ст. они как раз будут одинаковыми.
Кроме того, возможно получение и нестабильного состояния – переохлажденной жидкости. Но если в ней появится центр кристаллизации, она сразу же превратится в лед.
Температура в зависимости от показателя
Чтобы четко определить температуру замерзания, нужно сначала понять, как связаны эти 2 параметра.
Как они взаимосвязаны?
При увеличении давления, температура замерзания снижается, при уменьшении – t° растет. Существуют специальные формулы, которые помогают рассчитать конкретное значение.
Таблица таких соотношений выглядит следующим образом:
| Температура, °С | Давление, мПа |
| 0 | 0,1 |
| -1 | 1 |
| -2 | 30 |
| -3 | 40 |
| -4 | 50 |
| -5 | 60 |
| -10 | 110 |
| -22 | 210 |
Как происходит процесс?

Снижение температуры замерзания при увеличении давления имеет физическое обоснование.
Пресная жидкость при замерзании расширяется примерно на 10%. У соленой морской воды расширение будет меньшим, но оно все равно происходит.
Поэтому, когда внешнее давление растет, то температура замерзания снижается. Суть процесса замерзания состоит в кристаллизации воды.
Но в отличие от других жидкостей, вязкость воды при увеличении давления уменьшается. Что и обусловило более медленные процессы кристаллизации.
Это объясняется структурными особенностями молекул и некоторыми механизмами взаимодействия между ними. Для того, чтобы процесс начался, нужен центр кристаллизации, состоящий из нескольких десятков молекул.
Каково давление замерзающей жидкости?
Давление замерзающей воды обусловлено тем, что происходит ее расширение. Однако давление она оказывает и в жидком виде, просто при отрицательных температурах оно увеличивается примерно на 10%.
Как влияет тип воды?

Дистиллированная влага в принципе замерзает медленнее даже при нормальном атмосферном давлении. В отличие от других видов пресной воды, она не содержит сторонних примесей.
В ней отсутствуют ядра кристаллизации, и поэтому она замерзает только при очень низких температурах – эксперименты показали, что при -42°С.
Физики называют такую жидкость переохлажденной. Любопытно, что если постучать по сосуду с такой дистиллированной водой, она практически моментально превратится в лед.
В лабораторных условиях проводились эксперименты, при которых давление увеличивали до очень высоких значений, так что дистиллят замерзал только при -70°С.
Что касается остальных растворов, то здесь, помимо давления, важную роль играет еще и плотность – например, у соленой воды она намного выше.
Но при этом при отрицательных температурах частицы соли как бы выталкиваются. И если растопить многолетний морской лед, то окажется, что он состоит из пресной воды, даже пригодной для питья.
Применение знаний в быту человека

В основном сведения о температуре замерзания воды нужны тем, кто сталкивается с прокладкой водопровода.
Как правило, ее замерзание в таких случаях проходит не на подземном участке трубы, а над поверхностью почвы, и далее идет процесс кристаллизации уже в наземном участке.
Чтобы этого не происходило, поскольку замерзание и расширение воды выводит из строя всю систему и нарушает целостность труб, принимают активные и пассивные меры – от утепления трубы до специально обустроенной системы обогрева.
Но очень важно с самого начала правильно сделать расчеты, подбирая производительность оборудования и диаметр труб таким образом, чтобы создать такое давление, при котором вода не будет замерзать при климатических условиях, характерных для этого региона.
Заключение
Температура замерзания воды под давлением – вопрос более сложный, чем могло бы показаться на первый взгляд. Иногда даже в быту для ее расчета нужно применять громоздкие формулы или готовые таблицы соотношений.
Вопреки законам физики. Почему вода — это уникальное химическое соединение?

9 августа 1776 года родился итальянский химик Амедео Авогадро, впервые записавший химическую формулу воды как Н2O. Учёные и раньше знали о том, что это не химический элемент, а соединение водорода с кислородом в определённой пропорции, а слово «водород», собственно, и означало «порождающий воду». Но дальнейшие исследования показали, что за незатейливой формулой Н2О и структурой молекулы, имеющей симметричную V-образную форму, скрываются уникальные свойства вещества, без которого, как мы знаем, жизнь на Земле была бы невозможной.
АиФ.ru популярно объясняет, в чём же заключаются необычные свойства воды и почему они не подчиняются логике законов физики.

Природный аккумулятор тепла
Молекула Н2O — это два небольших атома водорода, присоединённые к крупному атому кислорода и образующие угол 104,45°. Такая структура отличает её от других трёхатомных молекул, где все атомы располагаются цепочкой. Это нестандартное расположение атомов и наделяет воду необычными свойствами, хотя дело не только в нём.
Во-первых, вода имеет аномально высокую теплоёмкость. Скажем, удельная теплоёмкость железа составляет 460, бетона — 880, керосина — 2140, а воды — аж 4200 Дж/(кг·°С)! Это значит, что, если вы захотите нагреть 1 килограмм воды на 1°С, вам придётся затратить значительно больше энергии, чем при аналогичном нагревании других жидкостей, да и не только их. Благодаря этому физическому свойству вода способна аккумулировать, т. е. надолго сохранять, тепло. А поскольку наше тело на две трети состоит из неё, это даёт ему возможность поддерживать температуру на одном уровне всегда — и жарким днём, и прохладной ночью. Высокая теплоёмкость воды защищает организм как от перегрева, так и от быстрого охлаждения. Будь иначе, любая тренировка и нагрузка на мышцы приводили бы к интенсивному разогреву тела и тепловому удару изнутри.

Аномально большая теплоёмкость воды полезна не только человеку и животным, но и окружающей среде в целом. Земные водоёмы, в первую очередь Мировой океан, являясь гигантскими аккумуляторами тепла, выступают в роли природных термостатов. То есть поддерживают температуру атмосферы в удобном для нас диапазоне. Летом они защищают планету от перегрева, зимой — от переохлаждения. Именно поэтому климат в прибрежных странах мягче: близость воды предохраняет его от резких перепадов температуры, чего не скажешь о территориях, расположенных в глубине континентов.
Второе тепловое свойство воды — её высокая удельная теплота плавления. Говоря простым языком, чтобы растопить лёд, нужно затратить много энергии. По этой причине снег весной тает медленно — почва успевает впитать в себя влагу и отправить её в реки. Конечно, без паводков не обходится, но если бы снег и лёд таяли быстрее, было бы гораздо хуже. С другой стороны, заморозить воду тоже трудно. Это её качество делает климат на планете в целом достаточно стабильным, хотя в последние десятилетия он и стал более капризным.

«Плавучее одеяло» для подводного мира
О том, что вода при замерзании расширяется, мы знаем с детства. Оставьте на морозе бутылку с водой — она лопнет. Но мало кто задумывается, что благодаря этому свойству воды на Земле и зародилась жизнь.
Большинство веществ при охлаждении и замерзании уменьшаются в объёме, что приводит к увеличению их плотности. А вот вода ведёт себя иначе. Охлаждаясь, она сначала тоже становится плотнее и сжимается, но, достигнув максимальной плотности при 4°С, затем начинает расширяться. В момент замерзания она и вовсе увеличивает объём скачкообразно — более чем на 8%.

Ещё вода — хороший растворитель, и за это чудесное свойство мы ей тоже должны сказать спасибо. Ведь благодаря ему в нашем организме протекают жизненно важные процессы: вода с растворёнными в ней компонентами твёрдых веществ становится поставщиком всех необходимых нам микроэлементов. Содержась в нашей крови и лимфе, она разносит питательные вещества по всем тканям и их клеткам.
Вода на Земле постоянно очищает саму себя: замерзая, она вытесняет из кристаллической решётки льда всё лишнее. Поэтому даже на поверхности грязной лужи будут плавать практически прозрачные льдинки. А растаяв, вода вновь начинает растворять в себе почти все твёрдые вещества, с которыми встречается и соприкасается. И это такой же циклический процесс, как её круговорот в природе.
Может ли вода оставаться жидкой при температуре ниже нуля?
Это может произойти несколькими способами. Рассмотрим их далее.
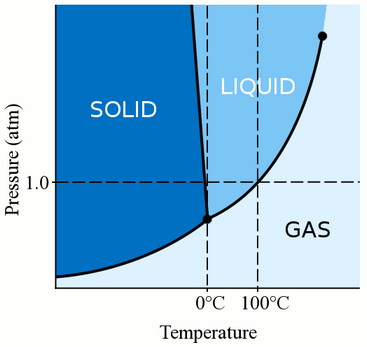
Давление
Прежде всего, фаза материала (будь то газ, жидкость или твёрдое вещество) сильно зависит как от его температуры, так и от давления.
Для большинства жидкостей давление поднимает температуру, при которой жидкость замерзает. Твёрдое тело образуется, когда свободные молекулы жидкости становятся достаточно медленными и достаточно близко располагаются друг к другу, чтобы сформировать стабильные связи, которые закрепляют их на месте. Когда мы оказываем давление на жидкость, мы заставляем молекулы сближаться. Поэтому они могут образовывать стабильные облигации и стать твёрдыми при более высокой температуре, чем температура замерзания при стандартном давлении.
Однако вода несколько уникальна.
Молекулы воды распространяются, когда они связываются в твёрдую кристаллическую структуру. Это действие делает лёд менее плотным, чем жидкостная вода, поэтому лёд плавает, а не тонет. Это действие молекул воды при замерзании также означает, что давление воды понижает температуру замерзания. Если вы примените достаточное давление (что затрудняет распространение молекул воды в твёрдую структуру), вы можете получить жидкую воду на несколько градусов ниже нуля градусов по Цельсию.
Добавки
Даже без давления вы можете получить жидкую воду при минусовой температуре, используя добавки. Такие добавки, как соль, могут помешать сформировать твёрдое тело и понизить температуру замерзания воды.
Соль состоит из сильных ионов натрия и хлора. Растворённые в воде, молекулы воды присоединяются к ионам соли, и поэтому не замерзают как охотно. По мере того, как вы добавляете больше соли в воду, точка замерзания продолжает падать, пока вода не достигнет насыщения и не сможет удерживать соль.
Если добавить достаточное количество соли, температура замерзания воды может упасть до -21 градуса Цельсия.
Этот факт означает, что вода при температуре -21 градус Цельсии может всё ещё быть жидкой (с достаточным количеством соли).
Это мощное свойство соли можно также использовать для того, чтобы дать льду превратиться обратно в воду. Посыпание солью ледяных тротуаров снижает температуру замерзания льда ниже температуры окружающей среды, и лёд тает.
Но посыпать солью обледеневшие дорожки не поможет, если температура окружающей среды ниже -21 градуса по Цельсию.
Воздействие соли на точку замерзания воды также оказывает глубокое воздействие на океаны Земли.
Другие методы. Переохлаждённая вода
Даже если вы не применяете давление и ничего не добавляете в воду, вы всё равно можете иметь жидкую воду при температуре ниже нуля градусов по Цельсию.
Для того, чтобы вода замёрзла до льда, ей нужно замёрзнуть, чтобы начать процесс. Эти отправные точки называются «центрами нуклеации». В большинстве случаев немного пыли, примесей или даже небольшие колебания в воде обеспечивают центры зарождения для замерзания воды. Но если ваша вода очень чистая и неподвижная, молекулам воды не на что кристаллизоваться. В результате вы можете охладить очень чистую воду ниже нуля градусов по Цельсию без замерзания.
Вода в таком состоянии называется «переохлаждённой».
Чистую воду можно переохладить до около -40 градус Цельсия.
Переохлаждённая вода удерживается от замерзания только отсутствием центров зарождения. Поэтому, как только появятся центры нуклеации (что может произойти от простой вибрации), супер-охлаждённая вода быстро замерзает.
Ледяной дождь — это естественный пример переохлаждённой жидкой воды. Как только дождь попадает на объект на поверхности Земли, объект обеспечивает центры нуклеации, и дождь замерзает до льда.
Какой обьект обеспечивает какие центры нуклеации? Что спрятано за этими терминами? — незнание!






